Arbeitsblatt: Chemie_Elemente Schreibweise
Material-Details
Verbindungen
Elemente
Atome
Chemie
Elemente / Periodensystem
7. Schuljahr
4 Seiten
Statistik
113306
1278
9
13.03.2013
Autor/in
Sara Martinez
Land: Schweiz
Registriert vor 2006
Textauszüge aus dem Inhalt:
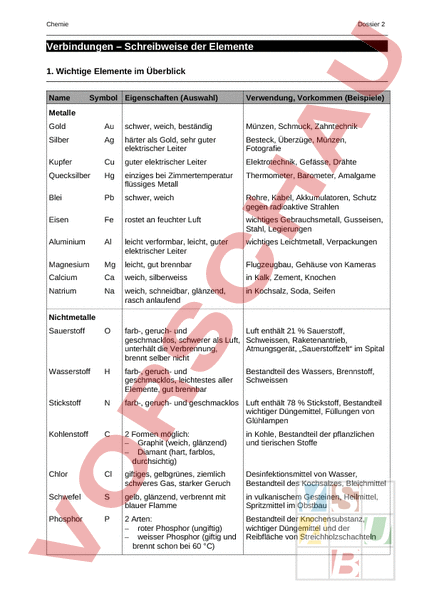
Chemie Dossier 2 Verbindungen – Schreibweise der Elemente 1. Wichtige Elemente im Überblick Name Symbol Eigenschaften (Auswahl) Verwendung, Vorkommen (Beispiele) Metalle Gold Au schwer, weich, beständig Münzen, Schmuck, Zahntechnik Silber Ag härter als Gold, sehr guter elektrischer Leiter Besteck, Überzüge, Münzen, Fotografie Kupfer Cu guter elektrischer Leiter Elektrotechnik, Gefässe, Drähte Quecksilber Hg einziges bei Zimmertemperatur flüssiges Metall Thermometer, Barometer, Amalgame Blei Pb schwer, weich Rohre, Kabel, Akkumulatoren, Schutz gegen radioaktive Strahlen Eisen Fe rostet an feuchter Luft wichtiges Gebrauchsmetall, Gusseisen, Stahl, Legierungen Aluminium Al leicht verformbar, leicht, guter elektrischer Leiter wichtiges Leichtmetall, Verpackungen Magnesium Mg leicht, gut brennbar Flugzeugbau, Gehäuse von Kameras Calcium Ca weich, silberweiss in Kalk, Zement, Knochen Natrium Na weich, schneidbar, glänzend, rasch anlaufend in Kochsalz, Soda, Seifen Sauerstoff farb-, geruch- und Luft enthält 21 Sauerstoff, geschmacklos, schwerer als Luft, Schweissen, Raketenantrieb, unterhält die Verbrennung, Atmungsgerät, „Sauerstoffzelt im Spital brennt selber nicht Wasserstoff farb-, geruch- und geschmacklos, leichtestes aller Elemente, gut brennbar Stickstoff farb-, geruch- und geschmacklos Luft enthält 78 Stickstoff, Bestandteil wichtiger Düngemittel, Füllungen von Glühlampen Kohlenstoff 2 Formen möglich: – Graphit (weich, glänzend) – Diamant (hart, farblos, durchsichtig) in Kohle, Bestandteil der pflanzlichen und tierischen Stoffe Chlor Cl giftiges, gelbgrünes, ziemlich schweres Gas, starker Geruch Desinfektionsmittel von Wasser, Bestandteil des Kochsalzes, Bleichmittel Schwefel gelb, glänzend, verbrennt mit blauer Flamme in vulkanischem Gesteinen, Heilmittel, Spritzmittel im Obstbau Phosphor 2 Arten: – roter Phosphor (ungiftig) – weisser Phosphor (giftig und brennt schon bei 60 C) Bestandteil der Knochensubstanz, wichtiger Düngemittel und der Reibfläche von Streichholzschachteln Nichtmetalle Bestandteil des Wassers, Brennstoff, Schweissen Chemie Dossier 2 2. Schreibweise der Elemente in der Chemie: Name Symbol Hauptgruppen/Nebengruppe Valenzelektronen: Schreibweise für die Chemie: Metalle Gold Au schwer, weich, beständig Münzen, Schmuck, Zahntechnik Silber Ag härter als Gold, sehr guter elektrischer Leiter Besteck, Überzüge, Münzen, Fotografie Kupfer Cu guter elektrischer Leiter Elektrotechnik, Gefässe, Drähte Quecksilber Hg einziges bei Zimmertemperatur flüssiges Metall Thermometer, Barometer, Amalgame Blei Pb schwer, weich Rohre, Kabel, Akkumulatoren, Schutz gegen radioaktive Strahlen Eisen Fe rostet an feuchter Luft wichtiges Gebrauchsmetall, Gusseisen, Stahl, Legierungen Aluminium Al leicht verformbar, leicht, guter elektrischer Leiter wichtiges Leichtmetall, Verpackungen Magnesium Mg leicht, gut brennbar Flugzeugbau, Gehäuse von Kameras Calcium Ca weich, silberweiss in Kalk, Zement, Knochen Natrium Na weich, schneidbar, glänzend, rasch anlaufend in Kochsalz, Soda, Seifen Sauerstoff farb-, geruch- und Luft enthält 21 Sauerstoff, geschmacklos, schwerer als Luft, Schweissen, Raketenantrieb, unterhält die Verbrennung, Atmungsgerät, „Sauerstoffzelt im Spital brennt selber nicht Wasserstoff farb-, geruch- und geschmacklos, leichtestes aller Elemente, gut brennbar Stickstoff farb-, geruch- und geschmacklos Luft enthält 78 Stickstoff, Bestandteil wichtiger Düngemittel, Füllungen von Glühlampen Kohlenstoff 2 Formen möglich: – Graphit (weich, glänzend) – Diamant (hart, farblos, durchsichtig) in Kohle, Bestandteil der pflanzlichen und tierischen Stoffe Chlor Cl giftiges, gelbgrünes, ziemlich schweres Gas, starker Geruch Desinfektionsmittel von Wasser, Bestandteil des Kochsalzes, Bleichmittel Schwefel gelb, glänzend, verbrennt mit blauer Flamme in vulkanischem Gesteinen, Heilmittel, Spritzmittel im Obstbau Phosphor 2 Arten: – roter Phosphor (ungiftig) – weisser Phosphor (giftig und brennt schon bei 60 C) Bestandteil der Knochensubstanz, wichtiger Düngemittel und der Reibfläche von Streichholzschachteln Nichtmetalle Bestandteil des Wassers, Brennstoff, Schweissen Chemie Dossier 2 3. Erklärung zur Symbolschreibweise von Elementen: 1. Jedes Element hat 0-7 Valenzelektronen. Also Elektronen, welche auf der letzten Schale herumschwirren. 2. Die Atome haben den Wunsch, diese Valenzelektronenzahl auf die Zahl 8 zu füllen. Aus diesem Grund verbinden sich Atome untereinander. Gemeinsam erreichen sie die 8er Valenzelektronenkonstellation. 3. Jedes Elektron kann sich mit einem anderen Elektron verbinden, so dass wir Elektronenpaare erhalten. 4. Hat ein Atom z.B. 7 Valenzelektronen und gehört somit zur Hauptgruppe 7, so kann er noch ein Elektron aufnehmen bis er komplett ist. Das Ziel ist es insgesamt 4 Elektronenpaare zu haben. 5. Atome die 1-4 Valenzelektronen besitzen, möchten ihre Elektronen zur Verbindung „abgeben. 6. Atome die 5-7 Valenzelektronen besitzen, möchten Elektronen zur Verbindung „aufnehmen. 7. Somit gibt es Atome, welche Elektronen abgeben und solche, welche Elektronen aufnehmen. 8. Die Verbindungen sind immer so zusammengestellt, dass Atome mit 1-4 Valenzelektronen sich mit Atomen mit 5-8 Elektronen zusammen tun, so dass sie gemeinsam ihre fehlenden Elektronenpaare ergänzen können. 4. Beispiele: Verbindungen zwischen Atome für die kompletten Elektronenpaare: Phosphor: Wasserstoff: Verbindung: Chlor: Natrium: Verbindung: Kohlenstoff: Calcium: Verbindung: Chemie Dossier 2 1. Auftrag: Sucht zu zweit oder alleine weitere mögliche Verbindungen und braucht das PSE dazu!