Arbeitsblatt: Test Redoxreaktionen
Material-Details
Serie A, update 2017
Chemie
Reduktion / Oxidation
9. Schuljahr
4 Seiten
Statistik
149074
1771
14
03.07.2019
Autor/in
Andreas Indermaur
Land: Schweiz
Registriert vor 2006
Textauszüge aus dem Inhalt:
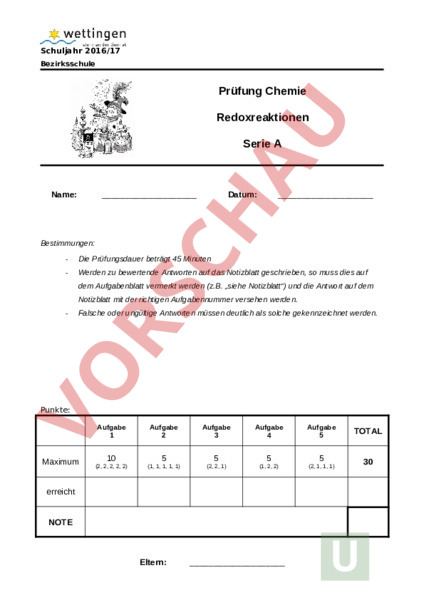
Schuljahr 2016/17 Bezirksschule Prüfung Chemie Redoxreaktionen Serie Name: Datum: Bestimmungen: Die Prüfungsdauer beträgt 45 Minuten Werden zu bewertende Antworten auf das Notizblatt geschrieben, so muss dies auf dem Aufgabenblatt vermerkt werden (z.B. „siehe Notizblatt) und die Antwort auf dem Notizblatt mit der richtigen Aufgabennummer versehen werden. Falsche oder ungültige Antworten müssen deutlich als solche gekennzeichnet werden. Punkte: Aufgabe 1 Maximum Aufgabe 2 Aufgabe 3 Aufgabe 4 Aufgabe 5 TOTAL 30 10 5 5 5 5 (2, 2, 2, 2, 2) (1, 1, 1, 1, 1) (2, 2, 1) (1, 2, 2) (2, 1, 1, 1) erreicht NOTE Eltern: 1. Redoxreaktionen Beim Thermitschweissen laufen Redoxreaktionen ab. Die Reaktionsgleichung lautet: 2 Al Fe2O3 2 Fe Al2O3 a) Zeichne mit 2 Pfeilen die Oxidation und Reduktion in der Reaktionsgleichung ein und gib an, welcher Stoff oxidiert und welcher reduziert wird: wird oxidiert. wird reduziert. b) Gib die Ionenladungen der 3 beteiligten Atomsorten vor und nach der Reaktion an: Vor der Reaktion: Al: Fe: O: Nach der Reaktion: Al: Fe: O: c) Wenn Phosphor verbrennt, reagieren die beiden Stoffe Phosphor und Sauerstoff miteinander zu Diphosphorpentoxid (P2O5). Notiere die Reaktionsgleichung und erkläre, warum ist das keine Redoxreaktion ist. d) Was versteht man unter einer Redoxreaktion im „klassischen Sinn? e) Notiere die korrekte Reaktionsgleichung einer beliebigen (!) Redoxreaktion ohne die Beteiligung von Sauerstoff. Notiere die Teilreaktionen und gib an, was mit den Elektronen geschieht. Was geschieht mit den Elektronen (e-)? Oxidation Reduktion 2. Metalle Bei der Eisenherstellung (Hochofenprozess) Reaktionsgleichung lautet vereinfacht: Fe2O3 laufen Redoxreaktionen Fe ab. Die CO2 a) Bestimme die Koeffizienten in der Reaktionsgleichung richtig. b) Gib an, welcher Stoff oxidiert und welcher Stoff reduziert wird: wird oxidiert. wird reduziert. Beim Hochofenprozess entsteht Eisen. Daraus wird in einem zweiten Verarbeitungsschritt Stahl hergestellt. c) Wo liegt, chemisch gesehen, der Unterschied zwischen Eisen und Stahl? d) Bei der Herstellung von Stahl aus Roheisen wird reiner Sauerstoff in das flüssige Eisen geblasen. Welche chemische Reaktion läuft dabei ab? Gib die Reaktionsgleichung an: e) Edelstähle sind Legierungen aus Eisen und anderen Metallen. Nenne 2 Eigenschaften von Stahl, welche sich durch das Legieren von Stahl mit anderen Metallen verbessern lassen: 3. Korrosionsprozesse a) Welche 3 Bedingungen müssen erfüllt sein, damit etwas (z. B. ein Auto) rosten kann? b) Wie können Gegenstände vor Korrosion geschützt werden? Nenne und erkläre zwei Methoden. c) Zu welcher Stoffgruppe gehört Rost? Begründe deine Antwort. 4. Brennstoffzelle a) Gib die Reaktionsgleichung der Knallgasreaktion an (Wasserstoff mit Sauerstoff): b) Welche Vorteile hat die Erzeugung von elektrischem Strom mit einer Brennstoffzelle gegenüber der Energiegewinnung in einem Wärmekraftwerk (z.B. Kohle- oder Erdgasverbrennung)? c) Wo liegen die Hauptschwierigkeiten, diese Technik für eine breite Öffentlichkeit nutzbar zu machen? 5. Atmung a) Der Mensch muss atmen, um den Körper mit Sauerstoff zu versorgen. Wofür braucht der Mensch den Sauerstoff? Beschreibe in Worten: b) Das skizzierte Molekül ist Glucose (Traubenzucker). Wie viele Kohlendioxidmoleküle entstehen beim vollständigen Abbau dieses Glucose-Moleküls im Körper? c) Wie viel wiegt ein Mol Glucose? d) Man hört oft die Aussage: „Wir Menschen atmen Sauerstoff ein und Kohlendioxid wieder aus! Diese Aussage stimmt so nur teilweise. Präzisiere sie.