Arbeitsblatt: Test Säuren und Basen
Material-Details
Serie A, update 2018
Chemie
Säuren / Basen
9. Schuljahr
4 Seiten
Statistik
149076
2240
17
03.07.2019
Autor/in
Andreas Indermaur
Land: Schweiz
Registriert vor 2006
Textauszüge aus dem Inhalt:
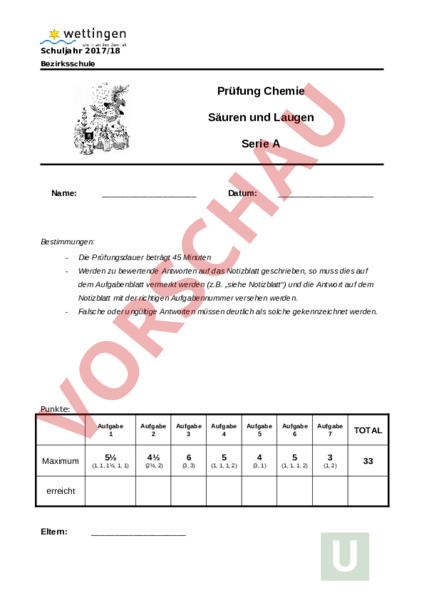
Schuljahr 2017/18 Bezirksschule Prüfung Chemie Säuren und Laugen Serie Name: Datum: Bestimmungen: Die Prüfungsdauer beträgt 45 Minuten Werden zu bewertende Antworten auf das Notizblatt geschrieben, so muss dies auf dem Aufgabenblatt vermerkt werden (z.B. „siehe Notizblatt) und die Antwort auf dem Notizblatt mit der richtigen Aufgabennummer versehen werden. Falsche oder ungültige Antworten müssen deutlich als solche gekennzeichnet werden. Punkte: Aufgabe 1 Maximum Aufgabe 2 Aufgabe 3 Aufgabe 5 Aufgabe 6 Aufgabe 7 5 4 6 5 4 5 3 (1, 1, 1, 1, 1) (2, 2) (3, 3) (1, 1, 1, 2) (3, 1) (1, 1, 1, 2) (1, 2) erreicht Eltern: Aufgabe 4 TOTAL 33 1. pH – Wert Säuren und Laugen kommen sehr häufig im Haushalt vor, v.a. in Lebensmitteln, Reinigungsmitteln, Hygieneartikeln etc. a) Nenne zwei saure Lebensmittel, welche sich im pH – Wert stark unterscheiden: b) Weshalb sind Hygieneartikel wie z. B. Seife meist leicht basisch und nicht ph – neutral? c) Säuren können z.B. Kalk (CaCO3) auflösen. Dabei kann man das Entstehen kleiner Bläschen beobachten. Beschreibe die Reaktionsgleichung, wenn Kalk von Salzsäure zersetzt wird: H2O Die entstandene Lösung enthält ein Salz. Wie heisst es? d) 0.25 Liter Säure mit einem pH – Wert von 4 soll mit Wasser verdünnt werden bis sie den pH – Wert 6 hat. Wie viel Wasser ist dazu notwendig? Rechnungsweg oder Begründung erforderlich! e) Was ist ein pH – Indikator? Nenne ein Beispiel. 2. Zwischenmolekulare Kräfte a) Welche zwischenmolekularen Kräfte können diese Stoffe ausbilden? Benenne die Stoffe (links) und verbinde richtig (Pfeile nach rechts ): NH3 Van-der-Waals-Kräfte CO2 HCl Wasserstoffbrücken O2 CaCO3 Dipo-Dipol-Bindungen b) Ordne die Substanzen CaCO3, NH3, O2 und HCl nach ihren Siedepunkten, beginnend mit derjenigen Substanz, welche den tiefsten Siedepunkt hat: Siedepunkt Siedepunkt Siedepunkt Siedepunkt 3. Hydratation a) Erkläre ausführlich, wie der Lösevorgang von Salzen in Wasser abläuft. b) Ordne die Salze Calciumfluorid, Calciumchlorid und Calciumbromid nach ihrer Löslichkeit in Wasser. Berechne die Energiebilanzen der Lösevorgänge der einzelnen Salze in Wasser und ordne danach die Salze den Löslichkeiten mit Pfeilen () zu: kJ/mol CaF2 740 g/l kJ/mol CaCl2 1420 g/l kJ/mol CaBr2 0.015 g/l 4. Säuren und Basen – chemisch betrachtet Wird festes Natriumhydroxid NaOH in Wasser aufgelöst, entsteht eine Base bzw. Lauge. a) Formuliere die richtige Reaktionsgleichung: H2O H2O b) Welche Konzentration hat eine Salzsäurelösung mit dem pH – Wert 1,25? Konzentration mol l c) Berechne den pH-Wert einer Natriumhydroxidlösung mit der Konzentration 0.015 mol/l? pH – Wert d) Welchen pH – Wert zeigen 1500 ml Salzsäure, welche 2.16 HCl enthalten? pH – Wert Notizen 5. Eigenschaften von Säuren und Basen a) Säuren können unedle Metalle zersetzen, z.B. Lithium. Beschreibe den Reaktionsverlauf (inkl. Reaktionsgleichung) von Salzsäure mit Lithium und die dabei entstehenden Endprodukte. Reaktionsgleichung: In Worten: b) Nenne zwei Verwendungszwecke für die wichtigste Industriesäure Schwefelsäure: 6. Neutralisation a) 15 ml 0.04 mol/l Salzsäure reagiert mit 5 ml 0.04 mol/l Kalilauge. Notiere die korrekte Reaktionsgleichung: HCl KOH b) Wie heisst das dabei entstandene Salz: c) Welche drei Gemeinsamkeiten weisen Neutralisationsreaktionen auf: Es entsteht. 1._ 2. 3. d) Welchen pH-Wert hat die entstandene Lösung? Notier den Rechnungsweg. pH – Wert 7. Saurer Regen a) Notiere ein Beispiel für eine Reaktionsgleichung, wie saurer Regen in der Atmosphäre aus den Schadstoff-Emissionen wie z.B. CO2, SO2, SO3 oder NO2 entsteht. H2O b) Wo sind die Schäden durch sauren Regen besonders gut sichtbar und warum gerade dort?