Arbeitsblatt: Praktische Herleitung einer Redoxtabelle
Material-Details
Versuchsbeschreibung zur Herleitung einer eigenen Redoxtabelle für 5 Metalle
Chemie
Reduktion / Oxidation
11. Schuljahr
2 Seiten
Statistik
151954
1553
1
01.10.2015
Autor/in
Claudia Ginsburg
Land: Schweiz
Registriert vor 2006
Textauszüge aus dem Inhalt:
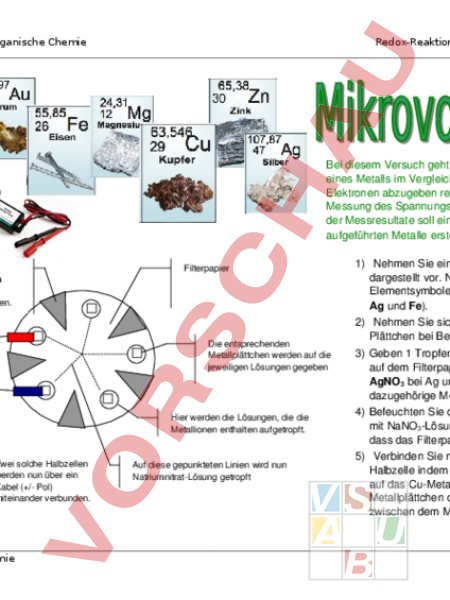
Anorganische Chemie Redox-Reaktionen: Erstellen einer Tabelle von Redoxpotentialen Bei diesem Versuch geht es um die Messung des Reduktionspotentials eines Metalls im Vergleich zu einem anderen (Bestreben eines Stoffes Elektronen abzugeben resp aufzunehmen). Das Messprinzip beruht auf der Messung des Spannungsunterschieds zwischen zwei Halbzellen. Aufgrund der Messresultate soll eine Tabelle der Reduktionspotentiale der aufgeführten Metalle erstellt werden. Diese Sektoren werden aus dem Filterpapier herausgeschnitten. Filterpapier Die entsprechenden Metallplättchen werden auf die jeweiligen Lösungen gegeben Hier werden die Lösungen, die die Metallionen enthalten aufgetropft. Zwei solche Halbzellen werden nun über ein Kabel (/ Pol) miteinander verbunden. Chemie Auf diese gepunkteten Linien wird nun NatriumnitratLösung getropft 1) Nehmen Sie ein Filterpapier und bereiten Sie es wie links dargestellt vor. Notieren Sie neben den kleinen Kreisen die Elementsymbole für die zu untersuchenden Metalle (Cu, Zn, Mg, Ag und Fe). 2) Nehmen Sie sich ein Plättchen jeder Metallsorte und reinigen Sie Plättchen bei Bedarf beidseitig mit Schmirgelpapier. 3) Geben 1 Tropfen Lösung auf den entsprechend markierten Punkt auf dem Filterpapier (CuSO4 bei Cu, ZnSO4 bei Zn, MgCl2 bei Mg, AgNO3 bei Ag und FeSO4 bei Fe). Danach legen Sie das dazugehörige Metallplättchen darauf. 4) Befeuchten Sie das Filterpapier entlang der gestrichelten Linien mit NaNO3Lösung. (Achten Sie während der Messung darauf, dass das Filterpapier nie austrocknet). 5) Verbinden Sie nun jeweils die CuHalbzelle mit einer anderen Halbzelle indem Sie den Pol (rot) des Spannungsmessgerätes auf das CuMetallplättchen und den Pol auf das andere Metallplättchen drücken. Achten Sie auf einen guten Kontakt zwischen dem Messfühler und dem Plättchen. Notieren Sie den Seite 1 Anorganische Chemie Redox-Reaktionen: Erstellen einer Tabelle von Redoxpotentialen Messwert. Messen Sie die Spannung zwischen der CuHalbzelle und jeder anderen Halbzelle. Auswertung der Messresultate: Die KupferHalbzelle ist die Vergleichszelle (ReferenzHalbzelle). Deshalb können keine absoluten Werte angeben werden. Es ist jedoch ein relativer Wert (im Vergleich zur KupferHalbzelle) ermittelbar. Hierfür wird das Reduktionspotential der ReferenzHalbzelle wird gleich Null gesetzt. Der Wert für die einzelnen Metalle ergibt sich nun aus der Differenz des Reduktionspotentials der ReferenzHalbzelle und dem Reduktionspotential der Halbzelle des jeweiligen Metalles (0 Messwert). Nun sind Sie in der Lage eine Tabelle der Reduktionspotentiale Ihrer fünf Metalle zu erstellen. Ordnen Sie die Metalle so in einer Tabelle an, dass Sie das Metall mit dem tiefsten Reduktionspotential (kleinste Zahl) an die erste Stelle (oben), dasjenige mit dem höchsten Reduktionspotential (grösste Zahl) an die letzte Stelle (unten) setzen. Jetzt ist es möglich für eine beliebige Kombination von diesen 5 Halbzellen die Spannung, die bei Verbinden der beiden Halbzellen gemessen wird, vorherzusagen. Zusatzaufgabe: Was für eine Spannung erwarten Sie wenn Sie z.B. eine ZnHalbzelle mit einer AgHalbzelle kombinieren? Was resultiert bei einer Messung zwischen einer MgHalbzelle und einer AuHalbzelle? (Kontrollieren Sie Ihre Vorhersage mit einer Messung) Chemie Seite 2 Anorganische Chemie Theoretische Spannung (Zn/Zn2 // Ag/Ag) Gemessene Spannung (Zn/Zn2 // Ag/Ag) Abweichung (in %) Chemie Redox-Reaktionen: Erstellen einer Tabelle von Redoxpotentialen Theoretische Spannung (Mg/Mg2 // Au3/Au) Gemessene Spannung (Mg/Mg2 // Au3/Au Abweichung (in %) Seite 3