Arbeitsblatt: Atombau und Isotope
Material-Details
kurze Wiederholung der Begriffe: Protonen, Elektronen, Neutronen, Isotop, Atommasse
Chemie
Atome
12. Schuljahr
2 Seiten
Statistik
32134
4331
23
07.01.2009
Autor/in
Maike Exner
Land: Deutschland
Registriert vor 2006
Textauszüge aus dem Inhalt:
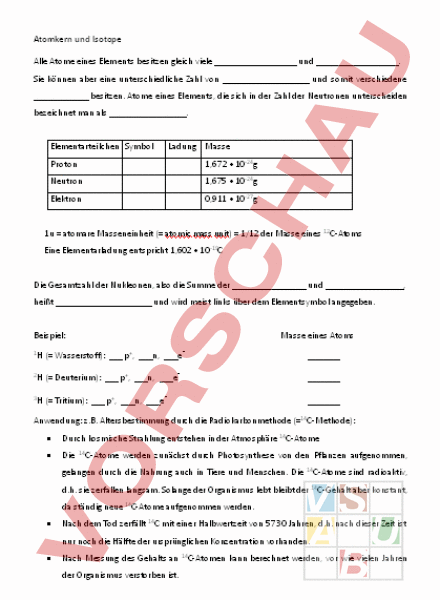
Atomkern und Isotope Alle Atome eines Elements besitzen gleich viele und . Sie können aber eine unterschiedliche Zahl von und somit verschiedene besitzen. Atome eines Elements, die sich in der Zahl der Neutronen unterscheiden bezeichnet man als. Elementarteilchen Symbol Ladung Masse Proton 1,672 • 10-24g Neutron 1,675 • 10-24g Elektron 0,911 • 10-27g 1u atomare Masseneinheit ( atomic mass unit) 1/12 der Masse eines 12C-Atoms Eine Elementarladung entspricht 1,602 • 10-19C Die Gesamtzahl der Nukleonen, also die Summe der und, heißt und wird meist links über dem Elementsymbol angegeben. Beispiel: Masse eines Atoms 1 ( Wasserstoff): p,n,e 2 ( Deuterium): p,n,e 3 ( Tritium): p,n,e Anwendung: z.B. Altersbestimmung durch die Radiokarbonmethode (14C-Methode): • Durch kosmische Strahlung entstehen in der Atmosphäre 14C-Atome • Die 14 C-Atome werden zunächst durch Photosynthese von den Pflanzen aufgenommen, gelangen durch die Nahrung auch in Tiere und Menschen. Die 14 C-Atome sind radioaktiv, d.h. sie zerfallen langsam. Solange der Organismus lebt bleibt der 14C-Gehalt aber konstant, da ständig neue 14C-Atome aufgenommen werden. • Nach dem Tod zerfällt 14C mit einer Halbwertzeit von 5730 Jahren, d.h. nach dieser Zeit ist nur noch die Hälfte der ursprünglichen Konzentration vorhanden. • Nach Messung des Gehalts an 14C-Atomen kann berechnet werden, vor wie vielen Jahren der Organismus verstorben ist. Atomkern und Isotope Alle Atome eines Elements besitzen gleich viele Protonen und Elektronen. Sie können aber eine unterschiedliche Zahl von Neutronen und somit verschiedene Atommassen besitzen. Atome eines Elements, die sich in der Zahl der Neutronen unterscheiden bezeichnet man als Isotope. Elementarteilchen Symbol Ladung Masse Proton p 1 1,672 • 10-24g 1u Neutron 0 1,675 • 10-24g 1u Elektron -1 0,911 • 10-27g 0,0005 1u atomare Masseneinheit ( atomic mass unit) 1/12 der Masse eines 12C-Atoms Eine Elementarladung entspricht 1,602 • 10-19C Die Gesamtzahl der Nukleonen, also die Summe der Protonen und Neutronen, heißt Massenzahl und wird meist links über dem Elementsymbol angegeben. Beispiel: Masse eines Atoms 1 ( Wasserstoff): 1 p, 0 n, 1 2 ( Deuterium): 1 p, 1 n, 1 3 ( Tritium): 1 p, 2 n, 1 1u 2u 3u Anwendung: z.B. Altersbestimmung durch die Radiokarbonmethode (14C-Methode): • Durch kosmische Strahlung entstehen in der Atmosphäre 14C-Atome • Die 14 C-Atome werden zunächst durch Photosynthese von den Pflanzen aufgenommen, gelangen durch die Nahrung auch in Tiere und Menschen. Die 14 C-Atome sind radioaktiv, d.h. sie zerfallen langsam. Solange der Organismus lebt bleibt der 14C-Gehalt aber konstant, da ständig neue 14C-Atome aufgenommen werden. • Nach dem Tod zerfällt 14C mit einer Halbwertzeit von 5730 Jahren, d.h. nach dieser Zeit ist nur noch die Hälfte der ursprünglichen Konzentration vorhanden. • Nach Messung des Gehalts an 14C-Atomen kann berechnet werden, vor wie vielen Jahren der Organismus verstorben ist.