Arbeitsblatt: Formelsammlung
Material-Details
Formalsammlung für Informatiker
Chemie
Gemischte Themen
klassenübergreifend
4 Seiten
Statistik
45829
625
1
16.09.2009
Autor/in
Gregor Kaufmann
Land: Schweiz
Registriert vor 2006
Textauszüge aus dem Inhalt:
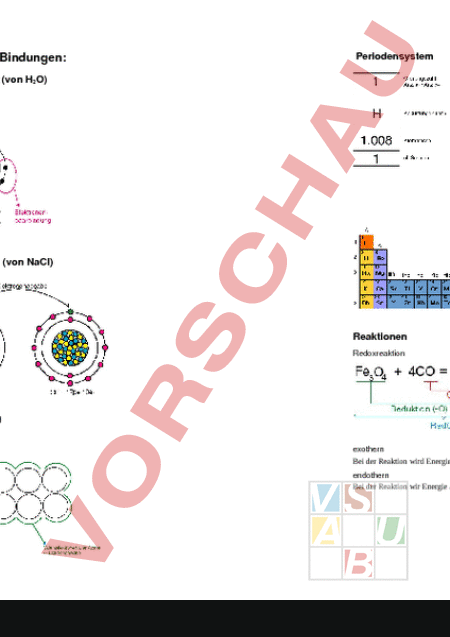
Chemie Chemie Wertigkeit Unterschied Chemie Physik Bildungsvermögen mit anderen Stoffen. Entspricht meist der Anzahl e- der äussersten Schale. 1 e- 7 e- 1-wertig, 2 e- 6 e- 2-wertig usw. Chemie: stoffliche Veränderungen, „neue Stoffe herstellen Physik: Lage, Zustand, Form von Stoffen Elektrolyt Kristallin Stoffe, die im geschmolzenen Zustand bewegliche Ionen enthalten Formelarten Angabe welche Atome miteinander verbunden sind. Summenformel C6H6 Gibt die Elemente und ihre Anzahl an. Strukturformel Gibt neben Elementen und Anzahl noch die „Form der Bindung an. Amorph H C C C C H Ion Zwischenstufe von flüssigen und festem Agregatszustand. Atome sind nicht in festen Atomgittern angeordnet. (Teer, Glas), Atomare Masseinheit (AME) u 1 12 der Masse des Isotops 1.67 10 24 12 6 Atomaufbau Protonen Elektrisch positiv geladen, Masse: 1AME Neutronen Elektrisch neutral, Masse: 1AME Atomhülle Besteht aus Schalen auf welchen sich die Elektronen befinden. Es können sich jeweils 2 Nummer der Schale Elektronen auf einer Schale befinden. Mit 8 Elektronen (Valenzelektronen) ist die äusserste Schale vollbesetzt. Anz. e- Anz. p - elektrisch Neutral Geladenes Atom Anzahl e- Anzahl p negative Ladung Anzahl e- Anzahl p positive Ladung Isotope Gleiche Atome mit gleichen chem. Eigenschaften. Unterschiedliche Anzahl unter. Atommasse Chemisch gesehen sind folgende Isotope immernoch Wasserstoff: 1p 1eWasserstoff 1p 1e- 1n Deuterium 1p 1e- 2n Tritium Nomenklatur Magnesiumchlorid: Magnesium Metall; Chlor Nichtmetall; id Salz oxid sulfid nitrid phosphid karbid (Verbindung von Kohlenstoff mit einem anderen Element) karbonat (Erze bei den das Metall mit Sauerstoff Kohlenstoff verbunden ist) chemische Bindungen: Periodensystem Atombindung (von H2O) Ionenbindung (von NaCl) Reaktionen Redoxreaktion Metallbindung exothern Bei der Reaktion wird Energie frei endothern Bei der Reaktion wir Energie aufgenommen Säuren Laugen Säure Wasserstoff H ist ein Anzeichen für eine Säure. Lauge Lösung der Metalle Natrium, Kalium und Kalzium in Wasser. HCl HCl- NaOH NaOH- HCl NaOH -- Säure Lauge -- NaCl H2O Salz Wasser Neutralisation 0 Säure ph-Wert 7 Neutral el-. Chemie 14 Lauge