Arbeitsblatt: Fällungsreaktionen
Material-Details
Praktikum zu Fällungsreaktionen
Chemie
Anderes Thema
11. Schuljahr
3 Seiten
Statistik
49307
1404
8
19.11.2009
Autor/in
Shabir Hansraj
Land: Schweiz
Registriert vor 2006
Textauszüge aus dem Inhalt:
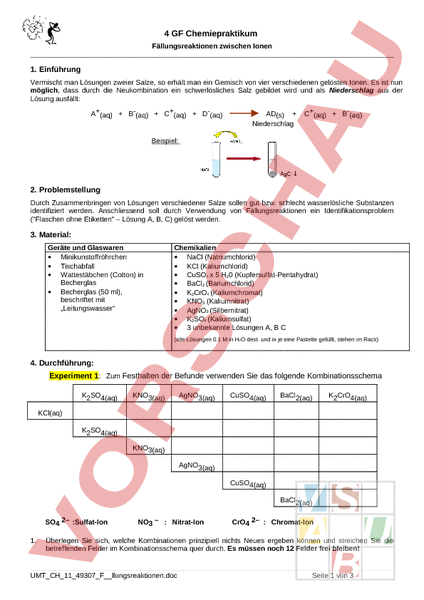
4 GF Chemiepraktikum Fällungsreaktionen zwischen Ionen 2 1. Einführung Vermischt man Lösungen zweier Salze, so erhält man ein Gemisch von vier verschiedenen gelösten Ionen. Es ist nun möglich, dass durch die Neukombination ein schwerlösliches Salz gebildet wird und als Niederschlag aus der Lösung ausfällt: A(aq) B-(aq) C(aq) D-(aq) AD(s) Niederschlag C(aq) B-(aq) Beispiel: 2. Problemstellung Durch Zusammenbringen von Lösungen verschiedener Salze sollen gut bzw. schlecht wasserlösliche Substanzen identifiziert werden. Anschliessend soll durch Verwendung von Fällungsreaktionen ein Identifikationsproblem (Flaschen ohne Etiketten – Lösung A, B, C) gelöst werden. 3. Material: Geräte und Glaswaren • Minikunstoffröhrchen • Tischabfall • Wattestäbchen (Cotton) in Becherglas • Becherglas (50 ml), beschriftet mit „Leitungswasser Chemikalien • NaCl (Natriumchlorid) • KCl (Kaliumchlorid) • CuSO4 5 H20 (Kupfersulfat-Pentahydrat) • BaCl2 (Bariumchlorid) • K2CrO4 (Kaliumchromat) • KNO3 (Kaliumnitrat) • AgNO3 (Silbernitrat) • K2SO4 (Kaliumsulfat) • 3 unbekannte Lösungen A, C (alle Lösungen 0.1 in H2O dest. und in je eine Pastette gefüllt, stehen im Rack) 4. Durchführung: Experiment 1: Zum Festhalten der Befunde verwenden Sie das folgende Kombinationsschema K2SO4(aq) KNO3(aq) AgNO3(aq) CuSO4(aq) BaCl2(aq) K2CrO4(aq) KCl(aq) K2SO4(aq) KNO3(aq) AgNO3(aq) CuSO4(aq) BaCl2(aq) SO4 2– :Sulfat-Ion 1. NO3 – Nitrat-Ion CrO4 2– Chromat-Ion Überlegen Sie sich, welche Kombinationen prinzipiell nichts Neues ergeben können und streichen Sie die betreffenden Felder im Kombinationsschema quer durch. Es müssen noch 12 Felder frei bleiben! . UMT_CH_11_49307_Fllungsreaktionen.doc Seite 1 von 3 2. 3. Zur Ausführung der restlichen Kombinationen wird in einem kleinen RG jeweils 1 Tropfen der beiden Lösungen vereinigt. Fällt hierbei ein Niederschlag aus, so erhält das betreffende Feld im Kombinationsschema ein Pluszeichen, andernfalls ein Minuszeichen. Finden Sie heraus, um welche neuen Salze es sich bei den ausgefällten Niederschlägen handeln muss. Dabei wird man sich jeweils fragen, von welchen Substanzen man sicher weiss, dass sie gut wasserlöslich sind. 4. Formulieren Sie auf der Rückseite dieses Blattes die Reaktionsgleichungen der Fällungsreaktionen 5. Notieren Sie in der folgenden Tabelle die nunmehr bekannten in Wasser gut bzw. schlecht löslichen Salze: gut lösliche Salze Formel Name schwer lösliche Salze Formel Name Aufräumen Entsorgung: Saugen Sie die Flüssigkeit in den Röhrchen mit einem Wattestäbchen auf und geben Sie das kontaminierte Wattestäbchen in den Tischabfall. Anschliessend nehmen Sie ein 2. Wattestäbchen, feuchten es an mit Leitungswasser und reiben das Röhrchen noch einmal aus (Reinigung). Dann nehmen sie die trockene Seite des Wattestäbchens, reiben das gereinigte Röhrchen damit noch einmal aus (Trocknen) und legen das Röhrchen auf das bereitgestellte Tablett. Das Wattestäbchen bitte wieder im Tischabfall entsorgen. . UMT_CH_11_49307_Fllungsreaktionen.doc Seite 2 von 3 Experiment 2: Lösung eines Identifikationsproblems Flaschen ohne Etiketten 1. Es ist bekannt, dass in den Flaschen A, und Lösungen von Kaliumnitrat, Silbernitrat und Bariumchlorid enthalten sind. Die Flaschen sind aber nicht entsprechend beschriftet. 2. Mit Hilfe einer Natriumchlorid-Lösung und einigen Reagenzgläsern soll festgestellt werden, welche der oben erwähnten Lösungen sich in welcher Flasche befindet. 3. Zur Lösung des Problems werden kleine Proben (1Tropfen) der Lösungen aus den Flaschen in die RG abgefüllt und sinnvoll kombiniert. Wie würden Sie vorgehen? (kurze Beschreibung) Zu welchem Ergebnis sind Sie gekommen? Flasche A: Flasche B: Flasche C: Aufräumen Entsorgung: Saugen Sie die Flüssigkeit in den Röhrchen mit einem Wattestäbchen auf und geben Sie das kontaminierte Wattestäbchen in den Tischabfall. Anschliessend nehmen Sie ein 2. Wattestäbchen, feuchten es an mit Leitungswasser und reiben das Röhrchen noch einmal aus zum Reinigen. Dann nehmen sie die trockene Seite des Wattestäbchens, reiben das gereinigte Röhrchen zum Trocknen aus und legen das Röhrchen auf das bereitgestellte Tablett. Das Wattestäbchen bitte wieder im Tischabfall entsorgen. . UMT_CH_11_49307_Fllungsreaktionen.doc Seite 3 von 3