Arbeitsblatt: Redoxreaktionen mit Metallen (Metallbäume unter der Lupe)
Material-Details
Redoxreaktionen von Metallen. Imposante Beobachtungen sich bildender Metallbäumchen unter der Lupe.
Chemie
Reduktion / Oxidation
9. Schuljahr
2 Seiten
Statistik
75256
2224
4
23.01.2011
Autor/in
Niklaus Gerber
Land: Schweiz
Registriert vor 2006
Textauszüge aus dem Inhalt:
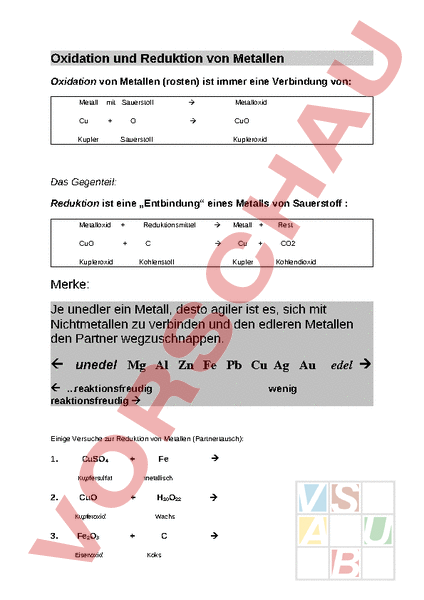
Oxidation und Reduktion von Metallen Oxidation von Metallen (rosten) ist immer eine Verbindung von: Metall mit Sauerstoff à Metalloxid Cu à CuO Kupfer Sauerstoff Kupferoxid Das Gegenteil: Reduktion ist eine „Entbindung eines Metalls von Sauerstoff Metalloxid CuO Reduktionsmittel Kupferoxid à Metall à Cu Kohlenstoff Kupfer Rest CO2 Kohlendioxid Merke: Je unedler ein Metall, desto agiler ist es, sich mit Nichtmetallen zu verbinden und den edleren Metallen den Partner wegzuschnappen. ß unedel Mg Al Zn Fe Pb Cu Ag Au ß reaktionsfreudig reaktionsfreudig à wenig Einige Versuche zur Reduktion von Metallen (Partnertausch): 1. CuSO4 Kupfersulfat 2. CuO Fe2O3 Eisenoxid à metallisch Kupferoxid 3. Fe H10O22 à Wachs Koks à edel à 4. Der Kupferbaum Kupfer verliert seinen Partner an Zink: CuSO4 Kupfersulfat Zn Zn SO4 à metallisch Cu Zinksulfat metallisch 5. Der Silberbaum Silber verliert seinen Partner an Kupfer: AgNO3 Silbernitrat Cu à metallisch Cu NO3 Kupfernitrat Ag metallisch 6. Der Bleibaum Blei verliert seinen Partner an Zink: PbNO3 Bleinitrat Zn metallisch à Zn NO3 Zinknitrat Pb metallisch